Презентация "кальций". Презентация "Кальций и его соединения" (9 класс) Презентация по химии на тему кальций
Кальций
Учитель химии ГБОУ школа № 644
г.Санкт-Петербурга НовосадоваН.И.


КАЛЬЦИЙ (лат. Calcium), Ca, химический элемент IIА группы периодической системы, атомный номер 20, атомная масса 40,078; относится к щелочноземельным металлам .
Название: название от латинского "calx", родительный падеж "calcis" (известь).

Строение атома
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2
p 20 , n 20, e 20
Ст.ок. +2, щелочно-земельный металл

Нахождение в природе:
по распространенности в земной коре кальций занимает 5-е место
(минералы:кальцит,мел,мрамор,
известняк - (CaCO 3 ) ,
фосфориты,апатиты - (Ca 3 (PO 4 ) 2 ),
доломиты – (CaCO 3 *MgCO 3 ),
флюорит (CaF 2), гипс (CaSO 4 *2H 2 O)
и другие соединения кальция.

CaF 2 - флюорит
CaСO 3 - мел
CaSO 4 ·2H 2 O- гипс
CaSO 4 - ангидрит

Физические свойства: серебристо-белый металл, плотность 1,54 г/см 3 , t пл = + 852 °С. При обычной температуре легко окисляется на воздухе.


2Ca + O 2 = 2CaO Ca 0 - 2 е Ca +2 восстановитель 2 O 0 +4 e 2 O -2 окислитель

II. взаимодействие со сложными веществами
1) с водой
Ca + 2H 2 O = Ca (OH) 2 + H 2
2) с кислотами C а + 2HC l = C a C l 2 + H 2





- он управляет биением нашего сердца,
- по его команде наши мышцы расслабляются или сокращаются,
- кальций передаёт сигналы по нервной системе,
- участвует в процессе свертывания крови,
- в процессах пищеварения, выделения, нервных процессах, влияет на иммунитет и на систему воспроизводства.

ВЫВОД: КАЛЬЦИЙ НЕОБХОДИМ НАШЕМУ ОРГАНИЗМУ!
900igr.net

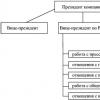
Жесткость воды обусловлена наличием в ней ионов Ca и Mg
Карбонатная – временная Ca(HCO 3) 2 , Mg(HCO 3) 2 , Fe(HCO 3) 2 .
Удаление («смягчение воды»):
Кипячением Ca(HCO 3) 2 =CaCO 3 +CO 2 +H 2 O
Добавление соды
Ca(HCO 3) 2 +Na 2 CO 3 =CaCO3+2NaHCO 3
Некарбонатная - постоянная CaCl 2 , CaSO 4 , MgCl 2 ,MgSO 4
Удаляется: добавлением соды
CaSO 4 +Na 2 CO 3 =CaCO 3 +Na 2 SO 4
MgSO 4 +Na 2 CO 3 +H 2 O=(Mg(OH)) 2 CO 2 +CO 2 +Na 2 SO 4


2.Физические свойства Ca:
Кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Природный кальций состоит из смеси шести изотопов с массовыми числами 40 (основной изотоп), 42, 43,44,46 и 48. В природе: CaCO 3 – мел, мрамор, известняк; CaSO 4 * 2H 2 O – гипс; Ca 3 (PO 4) 2 - фосфорит.

3.Получение Ca.
- Электролиз расплавов солей CaCl 2 =Ca+Cl 2 ;
- Из оксидов 2 Cao+2Al=2Ca+Al 2 O 3 ;
В промышленности кальций получают электролизом смеси расплавленных солей:6 частей хлорида кальция CaCl 2 и 1 часть фторида кальция CaF 2 . Последний добавляется для понижения температуры плавления хлорида кальция, при которой проводится электролиз.

4.Химические свойства Ca .
С простыми веществами:
- Ca+H 2 =CaH 2
- 3Ca+Cl 2 = CaCl 2 (галогениды)
3) 2Ca+O 2 =2CaO (кирпично-красное пламя)
Ca+O 2 =CaO 2 (пероксиды)
4) 3 Ca+N 2 =Ca 3 N 2
- Ca+2C=CaC (кар БИТ)
Ca+ 2 H 2 O=Ca(OH) 2 +H 2
Ca+2HCl=CaCl 2 +H 2
Ca+2NH 3 =Ca(NH 2) 2 +H 2

Соединения Ca
Оксид кальция CaO - «негашеная известь»
Получение: CaCO 3 =CaO+CO 2 (обжиг)
Химические свойства: CaO – основной оксид.
- CaO+H 2 O=Ca(OH) 2 – гашеная известь
- CaO+SiO 2 =CaSiO 3
- CaO+CO 2 =CaCO 3
- CaO+2HCl = CaCl2+H2O
- CaO+3C=CaC2 +CO (нагревание)
Гидроксид кальция Ca(OH)2 - «гашеная известь».
Получение: CaO+H2O=Ca(OH)2
Физические свойства: твердое вещество белого цвета, малорастворимое в воде.
Качественная реакция на Ca
Ca(OH)2 +CO2 =CaCO3+H2O – раствор мутнеет, при дальнейшем пропускании CO2 раствор становится прозрачным: CaCO3 +CO2 +H2O=Ca(HCO3)2
Применение соединений Ca: CaCl2 – водопоглащающее средство; CaS – для выделки кожи; Ca(OH)2 – в сельском хозяйстве, строительство.

Применение
Для изготовления свинцово-кальциевых сплавов, необходимых при производстве подшипников.


- Опишите физические свойства Ca .
- Получение кальция в промышленности.
- 1. КАЛЬЦИЙ – КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ
- 2. НЕМНОГО ОБ ИСТОРИИ…
- 3. РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ.
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА..
- 5. ХИМИЧЕСКИЕ СВОЙСТВА.
- 6. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ.
- В латинском языке слово «calx» обозначает известь и сравнительно мягкие, легко обрабатываемые камни, в первую очередь мел и мрамор. От этого слова и произошло название элемента №20.
- Природный элемент представляет смесь шести стабильных изотопов:
- 40Ca,
- 42Ca,
- 43Ca,
- 44Ca,
- 48Ca,
- из которых наиболее распространен 40Ca
- (96, 97%).
- Немецкий химик. Разработал ряд методов исследования химических веществ. Получил посредством электролиза кальций, марганец, магний и другие металлы.
- 1811-1899 гг.
- В биосфере происходит исключительно резкая дифференциация Ca, связанная главным образом с "карбонатным равновесием": при взаимодействии углекислого газа с карбонатом СаСО3 образуется растворимый бикарбонат Ca(HCO3)2:
- CaCO3 + H2O + CO2 = Ca(HCO3)2
- Эта реакция обратима и является основой перераспределения Ca.
- При высоком содержании CO2 в водах Ca находится в растворе,
- а при низком содержании CO2 в осадок выпадает минерал кальцит CaCO3,
- образуя мощные залежи известняка, мела, мрамора.
- Содержание кальция в организме человека достигает 2 %.
- Бетон – важнейший строительный материал наших дней,
- одной из составных частей которого является кальций.
- 1.Имеет металлическую кристаллическую решётку.
- 2.Атомный радиус - 1,97.
- 3.Ионный радиус Са2+- 1,04.
- 4.Плотность – 1,54 г/см3.
- 5.Теплопроводность – 125,6 Вт/м * К.
- 6.Удельная теплоёмкость – 623,9 дж/кг * К
- Кальций в результате реакции отдает 2 электрона, т.е. окисляется:
- Ca2+ – 2е → Caо
- электронная формула:
- 1s2 2s2 2p6 3s2 3p6 4s2
- Кальций взаимодействие с простыми веществами – неметаллами.
- Ca + 2 C = CaC2 карбид кальция
- 2. взаимодействие со сложными веществами:
- 2.1. с водой, с образованием водорода.
- Ca + H2O = Ca(OH)2 + H2
- 2.2.с кислотами: (кроме концентрированной HNO3)
- Ca + H2SO4 = CaSO4 + H2
- В промышленности кальций получают двумя способами:
- 1.Нагреванием брикетированной смеси СаО и порошка Al при 1200˚С в вакууме 0,01-0,02 мм.рт.ст.Выделяющиеся по реакции:6CaO+2Al=3CaO*l2O3+3Ca пары кальция конденсируются на холодной поверхности;
- 2.Электролизом расплава CaCl2 и KCl с жидким медно-кальциевым катодом приготовляют сплав Cu-Ca(65%Ca),из которого Ca отгоняют при температуре 950-1000˚С в вакууме 0,1-0,001 мм.рт.ст.
- http://www.chem100.ru/elem.php?n=20
- http://all-met.narod.ru/him.html
- http://images.yandex.ru/yandsearch?
- http://ru.wikipedia.org
- http://www.leovit.ru/calcium.html
- http://www.edimka.ru/text/sostav-produktov/caltsiy
1 слайд

2 слайд
Жесткость воды обусловлена наличием в ней ионов Ca и Mg Карбонатная – временная Ca(HCO3)2 , Mg(HCO3)2 , Fe(HCO3)2 . Удаление («смягчение воды»): - кипячением Ca(HCO3)2 =CaCO3 +CO2 +H2O - добавление соды Ca(HCO3)2 +Na2CO3 =CaCO3+2NaHCO3 Некарбонатная -постоянная CaCl2 , CaSO4 , MgCl2 ,MgSO4 Удаляется: добавлением соды CaSO4 +Na2CO3 =CaCO3 +Na2SO4 MgSO4 +Na2CO3 +H2 O=(Mg(OH))2 CO2 +CO2+Na2SO4

3 слайд
Нахождение в природе. Кальций относится к распространенным элементам. общее содержание его в земной коре составляет 3,6%. В природе наиболее широко распространены следующие соединения кальция: минерал кальцит CaCO3 (из него образованы массивы известняка, мрамора и мела), гипс CaSO4 *2H 2O ангидрит CaSO 4 . Кальций в виде фосфата Ca3 (PO4)2 входит в состав апатитов, фосфоритов и костей животных. Он содержится в природных водах и почвах.

4 слайд
2.Физические свойства Ca: Кальций – серебристо белый и довольно твердый металл, легкий. Температура плавления и кипения выше, чем у щелочных металлов. Природный кальций состоит из смеси шести изотопов с массовыми числами 40 (основной изотоп), 42, 43,44,46 и 48. В природе: CaCO3 – мел, мрамор, известняк; CaSO4 * 2H2O – гипс; Ca3(PO4)2 - фосфорит.

5 слайд
3.Получение Ca. Электролиз расплавов солей CaCl2=Ca+Cl2; Из оксидов 2Cao+2Al=2Ca+Al2O3 ; В промышленности кальций получают электролизом смеси расплавленных солей:6 частей хлорида кальция CaCl2 и 1 часть фторида кальция CaF 2. Последний добавляется для понижения температуры плавления хлорида кальция, при которой проводится электролиз.

6 слайд
4.Химические свойства Ca. С простыми веществами: Ca+H2 =CaH2 3Ca+Cl2 =CaCl2 (галогениды) 3) 2Ca+O2=2CaO (кирпично-красное пламя) Ca+O2 =CaO2 (пероксиды) 4) 3Ca+N2 =Ca3N2 Ca+2C=CaC (карБИТ) Ca+2H2O=Ca(OH)2 +H2 Ca+2HCl=CaCl2+H2 Ca+2NH3=Ca(NH2)2 +H2

7 слайд
Соединения Ca Оксид кальция CaO - «негашеная известь» Получение:CaCO3 =CaO+CO2 (обжиг) Химические свойства:CaO – основной оксид. CaO+H2O=Ca(OH)2 – гашеная известь CaO+SiO2 =CaSiO3 CaO+CO2 =CaCO3 CaO+2HCl = CaCl2+H2O CaO+3C=CaC2 +CO (нагревание) Гидроксид кальция Ca(OH)2 - «гашеная известь». Получение: CaO+H2O=Ca(OH)2 Физические свойства: твердое вещество белого цвета, малорастворимое в воде. Качественная реакция на Ca Ca(OH)2 +CO2 =CaCO3+H2O – раствор мутнеет, при дальнейшем пропускании CO2 раствор становится прозрачным:CaCO3 +CO2 +H2O=Ca(HCO3)2 Применение соединений Ca:CaCl2 – водопоглащающее средство; CaS – для выделки кожи; Ca(OH)2 – в сельском хозяйстве, строительство.