Ti металл. Самые интересные вещи из титана. Физические и химические свойства титана, получение титана
Инструкция
Открытие титана знаменательно тем, что его «родителями» являются сразу двое ученых – британец У. Грегор и немец М. Клапрот. Первый еще в 1791 году проводил исследования состава магнитного железистого песка, в результате чего был выделен неизвестный до этого момента металл. А в 1795-ом Клапрот проводил научные изыскания в части минерала рутила и также получил какой-то металл. Спустя десять лет уже француз Л. Воклен сам получил титан и доказал то, что предыдущие металлы были идентичны.
Полноценный образец химического элемента был получен ученым Й. Я. Берцелиусом в 1825 году, но он тогда считался сильно загрязненным, а уже чистый титан смогли получить двое голландцев – А. ванн Аркел и И. де Бур.
Титан является 10-ым по концентрации в природе химическим элементом среди всей периодической таблицы. Он есть в земной коре, морской воде, ультраосновных породах, в глинистой почве и в сланцах. Переносится элемент путем выветривания, после чего образуются крупные концентрации титана в россыпях. Минералы, содержащие в себе этот химический элемент – рутил, ильменит, титаномагнетит, перовскит, титанит, также различаются коренные титановые руды. Лидером по добыче элемента считаются Китай и Россия, но его запасы также есть в Украине, Японии, Австралии, Казахстане, в Южной Корее, Индии, Бразилии и на Цейлоне. В 2013 году мировое производство титана составило 4,5 млн тонн.
Плавится титан при температуре в 1660 градусов Цельсия, кипит - при 3260 градусах, плотность его - 4,32-4,505 г/см3. Химический элемент довольно пластичен и сваривается в инертной атмосфере, он очень вязкий, склонен к налипанию на инструмент резки, в силу чего данный процесс осуществляется только при использовании специальной смазки. Взрывоопасной считается титановая пыль при температуре вспыхивания в 400 градусов Цельсия, а металлическая стружка пожароопасна.
Титан устойчив к прогрессирующей коррозии, а также к растворам кислот и щелочей. Известно и то, что, в случае нагревания до Цельсия, элемент начинает гореть очень ярким белым пламенем и образует оксидные фазы. Путем воздействия водорода, алюминия и кремния титан частично преобразуется в трихлорид и дихлорид титана, представляющие собой твердые вещества с сильными восстановительными свойствами.
Отрасли применения титана – металлургия и литье, где из этого химического элемента изготовляют высокопрочные реакторы, трубопроводы, арматуру, медицинское оборудование (инструменты и протезы), а также многое другое. Интересно и то, что из титана частично выполнен памятник Юрию Гагарину на одноименной площади в Москве.
Монумент в честь покорителей космоса воздвигнут в Москве в 1964 г. Почти семь лет (1958-1964) ушло на проектирование и сооружение этого обелиска. Авторам пришлось решать не только архитектурнохудожественные, но и технические задачи. Первой из них был выбор материалов, в том числе и облицовочных. После долгих экспериментов остановились на отполированных до блеска титановых листах.
Действительно, по многим характеристикам, и прежде всего по коррозионной стойкости, титан превосходит подавляющее большинство металлов и сплавов. Иногда (особенно в популярной литературе) титан называют вечным металлом. Но расскажем сначала об истории этого элемента.
Окисел или не окисел?
До 1795 г. элемент № 22 назывался «менакином». Так назвал его в 1791 г. английский химик и минералог Уильям Грегор, открывший новый элемент в минерале менаканите (не ищите это название в современных минералогических справочниках - менаканит тоже переименован, сейчас он называется ильменитом).
Спустя четыре года после открытия Грегора немецкий химик Мартин Клапрот обнаружил новый химический элемент в другом минерале - рутиле - ив честь царицы эльфов Титании (германская мифология) назвал его титаном.
По другой версии название элемента происходит от титанов, могучих сыновей богини земли - Геи (греческая мифология).
В 1797 г. выяснилось, что Грегор и Клапрот открыли один и тот же элемент, и хотя Грегор сделал это раньше, за новым элементом утвердилось имя, данное ему Клапротом.
Но ни Грегору, ни Клапроту не удалось получить элементный титан . Выделенный ими белый кристаллический порошок был двуокисью титана TiO 2 . Восстановить этот окисел, выделить из пего чистый металл долгое время не удавалось никому из химиков.
В 1823 г. английский ученый У. Волластон сообщил, что кристаллы, обнаруженные им в металлургических шлаках завода «Мертир-Тидвиль», - не что иное, как чистый титан. А спустя 33 года известный немецкий химик Ф. Вёлер доказал, что и эти кристаллы были опять-таки соединением титана, на этот раз - металлоподобным карбонитридом.
Много лет считалось, что металлический титан впервые был получен Берцелиусом в 1825 г. при восстановлении фтортитаната калия металлическим натрием . Однако сегодня, сравнивая свойства титана и продукта, полученного Берцелиусом, можно утверждать, что президент Шведской академии наук ошибался, ибо чистый titabnum быстро растворяется в плавиковой кислоте (в отличие от многих других кислот), а металлический титан Берцелиуса успешно сопротивлялся ее действию.
В действительности Ti был впервые получен лишь в 1875 г. русским ученым Д. К. Кирилловым. Результаты этой работы опубликованы в его брошюре «Исследования над титаном». Но работа малоизвестного русского ученого осталась незамеченной. Еще через 12 лет довольно чистый продукт - около 95% титана - получили соотечественники Берцелиуса, известные химики Л. Нильсон и О. Петерсон, восстанавливавшие четыреххлористый титан металлическим натрием в стальной герметической бомбе.
В 1895 г. французский химик А. Муассан, восстанавливая двуокись титана углеродом в дуговой печи и подвергая полученный материал двукратному рафинированию, получил титан, содержавший всего 2% примесей, в основном углерода. Наконец, в 1910 г. американский химик М. Хантер, усовершенствовав способ Нильсона и Петерсона, сумел получить несколько граммов титана чистотой около 99%. Именно поэтому в большинстве книг приоритет получения металлического титана приписывается Хантеру, а не Кириллову, Нильсону или Муассану.
Однако ни Хантер, ни его современники не предсказывали титану большого будущего. Всего несколько десятых процента примесей содержалось в металле, но эти примеси делали титан хрупким, непрочным, непригодным к механической обработке. Поэтому некоторые соединения титана нашли применение раньше, чем сам металл. Четыреххлористый Ti, например, широко использовали в первую мировую войну для создания дымовых завес.
№22 в медицине
В 1908 г. в США и Норвегии началось изготовление белил не из соединений свинца и цинка , как делалось прежде, а из двуокиси титана. Такими белилами можно окрасить в несколько раз большую поверхность, чем тем же количеством свинцовых или цинковых белил. К тому же у титановых белил больше отражательная способность, они не ядовиты и не темнеют под действием сероводорода. В медицинской литературе описан случай, когда человек за один раз «принял» 460 г двуокиси титана! (Интересно, с чем он ее спутал?) «Любитель» двуокиси титана не испытал при этом никаких болезненных ощущений. TiO 2 входит в состав некоторых медицинских препаратов, в частности мазей против кожных болезней.
Однако не медицина, а лакокрасочная промышленность потребляет наибольшие количества TiO 2 . Мировое производство этого соединения намного превысило полмиллиона тонн в год. Эмали на основе двуокиси титана широко используют в качестве защитных и декоративных покрытий по металлу и дереву в судостроении, строительстве и машиностроении. Срок службы сооружений и деталей при этом значительно повышается. Титановыми белилами окрашивают ткани, кожу и другие материалы.
Ti в промышленности
Двуокись титана входит в состав фарфоровых масс, тугоплавких стекол, керамических материалов с высокой диэлектрической проницаемостью. Как наполнитель, повышающий прочность и термостойкость, ее вводят в резиновые смеси. Однако все достоинства соединений титана кажутся несущественными на фоне уникальных свойств чистого металлического титана.
Элементный титан
В 1925 г. голландские ученые ван Аркель и де Бур иодидным способом (о нем - ниже) получили титан высокой степени чистоты - 99,9%. В отличие от титана, полученного Хантером, он обладал пластичностью: его можно было ковать на холоде, прокатывать в листы, ленту, проволоку и даже тончайшую фольгу. Но даже не это главное. Исследования физикохимических свойств металлического титана приводили к почти фантастическим результатам. Оказалось, например, что титан, будучи почти вдвое легче железа (плотность титана 4,5 г/см 3), по прочности превосходит многие стали. Сравнение с алюминием тоже оказалось в пользу титана: титан всего в полтора раза тяжелее алюминия, но зато в шесть раз прочнее и, что особенно важно, он сохраняет свою прочность при температурах до 500°С (а при добавке легирующих элементов - до 650°С), в то время как прочность алюминиевых и магниевых сплавов резко падает уже при 300°С.
Титан обладает и значительной твердостью: он в 12 раз тверже алюминия, в 4 раза - железа и меди . Еще одна важная характеристика металла - предел текучести. Чем он выше, тем лучше детали из этого металла сопротивляются эксплуатационным нагрузкам, тем дольше они сохраняют свои формы и размеры. Предел текучести у титана почти в 18 раз выше, чем у алюминия.
В отличие от большинства металлов титан обладает значительным электросопротивлением: если электропроводность серебра принять за 100, то электропроводность меди равна 94, алюминия - 60, железа и платины - 15, а титана - всего 3,8. Вряд ли нужно объяснять, что это свойство, как и немагнитность титана, представляет интерес для радиоэлектроники и электротехники.
Замечательна устойчивость титана против коррозии. На пластинке из этого металла за 10 лет пребывания в морской воде не появилось и следов коррозии. Из титановых сплавов сделаны несущие винты современных тяжелых вертолетов. Рули поворота, элероны и некоторые другие ответственные детали сверхзвуковых самолетов тоже изготовлены из этих сплавов. На многих химических производствах сегодня можно встретить целые аппараты и колонны, выполненные из титана.
Как получают титан
Цена - вот что еще тормозит производство и потребление титана. Собственно, высокая стоимость - не врожденный порок титана. В земной коре его много - 0,63%. Все еще высокая цена титана - следствие сложности извлечения его из руд. Объясняется она высоким сродством титана ко многим элементам и прочностью химических связей в его природных соединениях. Отсюда - сложности технологии. Вот как выглядит магниетермический способ производства титана, разработанный в 1940 г. американским ученым В. Кроллем.
Двуокись титана с помощью хлора (в присутствии углерода) переводят в четыреххлористый титан:
HO 2 + C + 2CI 2 → HCI 4 + CO 2 .
Процесс идет в шахтных электропечах при 800-1250°С. Другой вариант - хлорирование в расплаве солей щелочных металлов NaCl и KCl Следующая операция (в одинаковой мере важная и трудоемкая) - очистка TiCl 4 от примесей - проводится разными способами и веществами. Четыреххлористый титан в обычных условиях представляет собой жидкость с температурой кипения 136°С.
Разорвать связь титана с хлором легче, чем с кислородом. Это можно сделать с помощью магния по реакции
TiCl 4 + 2Mg → T + 2MgCl 2 .
Эта реакция идет в стальных реакторах при 900°С. В результате образуется так называемая титановая губка, пропитанная магнием и хлоридом магния. Их испаряют в герметичном вакуумном аппарате при 950°С, а титановую губку затем спекают или переплавляют в компактный металл.
Натриетермический метод получения металлического титана в принципе мало чем отличается от магниетермического. Эти два метода наиболее широко применяются в промышленности. Для получения более чистого титана и поныне используется иодидный метод, предложенный ван Аркелем и де Буром. Металлотермический губчатый титан превращают в иодид TiI 4 , который затем возгоняют в вакууме. На своем пути пары иодида титапа встречают раскаленную до 1400°С титановую проволоку. При этом иодид разлагается, и на проволоке нарастает слой чистого титана. Этот метод производства титана малопроизводителен и дорог, поэтому в промышленности он применяется крайне ограниченно.
Несмотря на трудоемкость и энергоемкость производства титана, оно уже стало одной из важнейших подотраслей цветной металлургии. Мировое производство титана развивается очень быстрыми темпами. Об этом можно судить даже по тем обрывочным сведениям, которые попадают в печать.
Известно, что в 1948 г. в мире было выплавлено лишь 2 т титана, а спустя 9 лет - уже 20 тыс. т. Значит, в 1957 г. 20 тыс. т титана приходилось на все страны, а в 1980 г. только США потребляли. 24,4 тыс. т. титана... Еще недавно, кажется, титан называли редким металлом - сейчас он важнейший конструкционный материал. Объясняется это только одним: редким сочетанием полезных свойств элемента № 22. И, естественно, потребностями техники.
Роль титана как конструкционного материала, основы высокопрочных сплавов для авиации, судостроения и ракетной техники, быстро возрастает. Именно в сплавы идет большая часть выплавляемого в мире титана. Широко известен сплав для авиационной промышленности, состоящий из 90% титана, 6% алюминия и 4% ванадия . В 1976 г. в американской печати появились сообщения о новом сплаве того же назначения: 85% титана, 10% ванадия, 3% алюминия и 2% железа. Утверждают, что этот сплав не только лучше, но и экономичнее.
А вообще в титановые сплавы входят очень многие элементы, вплоть до платины и палладия . Последние (в количестве 0,1-0,2%) повышают и без того высокую химическую стойкость титановых сплавов.
Прочность титана повышают и такие «легирующие добавки», как азот и кислород. Но вместе с прочностью они повышают твердость и, главное, хрупкость титана, поэтому их содержание строжайше регламентируется: в сплав допускается не более 0,15% кислорода и 0,05% азота.
Несмотря на то что титан дорог, замена им более дешевых материалов во многих случаях оказывается экономически выгодной. Вот характерный пример. Корпус химического аппарата, изготовленный из нержавеющей стали, стоит 150 рублей, а из титанового сплава - 600 рублей. Но при этом стальной реактор служит лишь 6 месяцев, а титановый - 10 лет. Прибавьте затраты на замену стальных реакторов, вынужденные простои оборудования - и станет очевидно, что применять дорогостоящий титан бывает выгоднее, чем сталь.
Значительные количества титана использует металлургия. Существуют сотни марок сталей и других сплавов, в состав которых титан входит как легирующая добавка. Его вводят для улучшения структуры металлов, увеличения прочности и коррозийной стойкости.
Некоторые ядерные реакции должны совершаться в почти абсолютной пустоте. Ртутными насосами разрежение может быть доведено до нескольких миллиардных долей атмосферы. Но этого недостаточно, а ртутные насосы на большее неспособны. Дальнейшая откачка воздуха осуществляется уже особыми титановыми насосами. Кроме того, для достижения еще большего разрежения по внутренней поверхности камеры, где протекают реакции, распыляют мелкодисперсный титан.
Титан часто называют металлом будущего. Факты, которыми уже сейчас располагают наука и техника, убеждают, что это не совсем так - титан уже стал металлом настоящего.
Перовскит и сфен . Ильменит - метатитанат железа FeTiO 3 - содержит 52,65% TiO 2 . Название этого минерала связано с тем, что он был найден на Урале в Ильменских горах. Крупнейшие россыпи ильменитовых песков имеются в Индии. Другой важнейший минерал - рутил представляет собой двуокись титана. Промышленное значение имеют также титаномагнетиты - природная смесь ильменита с минералами железа. Богатые месторождения титановых руд есть в СССР, США, Индии, Норвегии, Канаде, Австралии и других странах. Не так давно геологи открыли в Северном Прибайкалье новый титансодержащий минерал, который был назван ландауитом в честь советского физика академика Л. Д. Ландау. Всего на земном шаре известно более 150 значительных рудных и россыпных месторождений титана.
Основная часть титана расходуется на нужды авиационной и ракетной техники и морского судостроения. Его, а также ферротитан используют как легирующую добавку к качественным сталям и как раскислитель. Технический титан идет на изготовление емкостей, химических реакторов, трубопроводов, арматуры, насосов, клапанов и других изделий, работающих в агрессивных средах. Из компактного титана изготавливают сетки и другие детали электровакуумных приборов, работающих при высоких температурах.
По использованию в качестве конструкционного материала Ti находится на 4-ом месте, уступая лишь Al, Fe и Mg. Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов. Биологическая безвредность данного металла делает его превосходным материалом для пищевой промышленности и восстановительной хирургии.
Титан и его сплавы нашли широкое применение в технике ввиду своей высокой механической прочности, которая сохраняется при высоких температурах, коррозионной стойкости, жаропрочности, удельной прочности, малой плотности и прочих полезных свойств. Высокая стоимость данного металла и материалов на его основе во многих случаях компенсируется их большей работоспособностью, а в некоторых случаях они являются единственным сырьем, из которого можно изготовить оборудование или конструкции, способные работать в данных конкретных условиях.
Титановые сплавы играют большую роль в авиационной технике, где стремятся получить наиболее легкую конструкцию в сочетании с необходимой прочностью. Ti легок по сравнению с другими металлами, но в то же время может работать при высоких температурах. Из материалов на основе Ti изготавливают обшивку, детали крепления, силовой набор, детали шасси, различные агрегаты. Также данные материалы применяются в конструкциях авиационных реактивных двигателей. Это позволяет уменьшить их массу на 10-25%. Из титановых сплавов производят диски и лопатки компрессоров, детали воздухозаборников и направляющих в двигателях, различный крепеж.
Еще одной областью применения является ракетостроение. Ввиду кратковременной работы двигателей и быстрого прохождения плотных слоев атмосферы в ракетостроении в значительной мере снимаются проблемы усталостной прочности, статической выносливости и отчасти ползучести.
Технический титан из-за недостаточно высокой тепловой прочности не пригоден для применения в авиации, но благодаря исключительно высокому сопротивлению коррозии в ряде случаев незаменим в химической промышленности и судостроении. Так его применяют при изготовлении компрессоров и насосов для перекачки таких агрессивных сред, как серная и соляная кислота и их соли, трубопроводов, запорной арматуры, автоклав, различного рода емкостей, фильтров и т. п. Только Ti обладает коррозионной стойкостью в таких средах, как влажный хлор, водные и кислые растворы хлора, поэтому из данного металла изготовляют оборудование для хлорной промышленности. Также из него делают теплообменники, работающие в коррозионно активных средах, например в азотной кислоте (не дымящей). В судостроении титан используется для изготовления гребных винтов, обшивки морских судов, подводных лодок, торпед и т.д. На данный материал не налипают ракушки, которые резко повышают сопротивление судна при его движении.
Титановые сплавы перспективны для использования во многих других применениях, но их распространение в технике сдерживается высокой стоимостью и недостаточной распространенностью данного металла.
Соединения титана также получили широкое применение в различных отраслях промышленности. Карбид (TiC) обладает высокой твердостью и применяется в производстве режущих инструментов и абразивных материалов. Белый диоксид (TiO 2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Титанорганические соединения (например, тетрабутоксититан) применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности. Неорганические соединения Ti применяются в химической электронной, стекловолоконной промышленности в качестве добавки. Диборид (TiB 2)- важный компонент сверхтвердых материалов для обработки металлов. Нитрид (TiN) применяется для покрытия инструментов.
Вечный, загадочный, космический, - все эти и многие другие эпитеты присваиваются в различных источниках титану. История открытия этого металла не была тривиальной: одновременно над выделением элемента в чистом виде трудились несколько ученых. Процесс изучения физических, химических свойств и определение областей его применения на сегодняшний день. Титан - металл будущего, место его в жизни человека еще окончательно не определено, что дает современным исследователям огромный простор для творчества и научных изысканий.
Характеристика
Химический элемент обозначается в периодической таблице Д. И. Менделеева символом Ti. Располагается в побочной подгруппе IV группы четвертого периода и имеет порядковый номер 22. титан - металл бело-серебристого цвета, легкий и прочный. Электронная конфигурация атома имеет следующую структуру: +22)2)8)10)2, 1S 2 2S 2 2P 6 3S 2 3P 6 3d 2 4S 2 . Соответственно, титан имеет несколько возможных степеней окисления: 2, 3, 4, в наиболее устойчивых соединениях он четырехвалентен.
Титан - сплав или металл?
Этот вопрос интересует многих. В 1910 году американский химик Хантер получил впервые чистый титан. Металл содержал всего 1 % примесей, но при этом его количество оказалось ничтожно мало и не давало возможности дальнейшего исследования его свойств. Пластичность полученного вещества достигалась толькопод воздействием высоких температур, при нормальных условиях (комнатной температуре) образец был слишком хрупок. Фактически этот элемент не заинтересовал ученых, так как перспективы его использования казались слишком неопределенными. Сложность получения и исследования еще больше снизили потенциал его применения. Только в 1925 году ученые-химики из Нидерландов И. де Бур и А. Ван-Аркел получили металл титан, свойства которого привлекли внимание инженеров и конструкторов всего мира. История исследования этого элемента начинается с 1790 года, именно в это время параллельно, независимо друг от друга, двое ученых открывают титан как химический элемент. Каждый из них получает соединение (оксид) вещества, не сумев выделить металл в чистом виде. Первооткрывателем титана считается английский минеролог монах Уильям Грегор. На территории своего прихода, расположенного в юго-западной части Англии, молодой ученый начал изучение черного песка долины Менакэна. Результатом стало выделение блестящих крупиц, которые являлись соединением титана. В это же время в Германии химик Мартин Генрих Клапрот выделил новое вещество из минерала рутиле. В 1797 году он же доказал, что открытые параллельно элементы являются аналогичными. Двуокись титана более века являлась загадкой для многих химиков, получить чистый металл оказалось не по силам даже Берцелиусу. Новейшие технологии XX века значительно ускорили процесс изучения упомянутого элемента и определили начальные направления его использования. При этом сфера применения расширяется постоянно. Ограничить её рамки может только сложность процесса получения такого вещества, как чистый титан. Цена сплавов и металла достаточно высока, поэтому на сегодняшний день он не может вытеснить традиционное железо и алюминий.

Происхождение названия
Менакин - первое название титана, которое применялось до 1795 года. Именно так, по территориальной принадлежности, назвал новый элемент У. Грегор. Мартин Клапрот присваивает элементу в 1797 году наименование «титан». В это время его французские коллеги во главе с достаточно авторитетным химиком А. Л. Лавуазье предлагают именовать вновь открытые вещества в соответствии с их основными свойствами. Немецкий ученый не был согласен с таким подходом, он вполне обоснованно считал, что на стадии открытия достаточно сложно определить все характеристики, свойственные веществу, и отразить их в названии. Однако следует признать, что интуитивно выбранный Клапротом термин в полной мере соответствует металлу - это неоднократно подчеркивали современные ученые. Существуют две основные теории возникновения названия титан. Металл мог быть обозначен так в честь эльфийской царицы Титании (персонаж германской мифологии). Такое название символизирует одновременно легкость и прочность вещества. Большинство ученых склоняются к версии использования древнегреческой мифологии, в которой титанами называли могучих сыновей богини земли Геи. В пользу этой версии говорит и название открытого ранее элемента - урана.

Нахождение в природе
Из металлов, которые в техническом отношении представляют ценность для человека, титан занимает четвертое место по степени распространенности в земной коре. Большим процентным содержанием в природе характеризуются только железо, магний и алюминий. Наибольшее содержание титана отмечено в базальтовой оболочке, чуть меньше его в гранитном слое. В морской воде содержание данного вещества невысокое - приблизительно 0,001 мг/л. Химический элемент титан достаточно активен, поэтому в чистом виде его встретить невозможно. Чаще всего он присутствует в соединениях с кислородом, при этом имеет валентность, равную четырем. Количество титаносодержащих минералов варьируется от 63 до 75 (в различных источниках), при этом на современном этапе исследований ученые продолжают открывать новые формы его соединений. Для практического использования наибольшее значение имеют следующие минералы:
- Ильменит (FeTiO 3).
- Рутил (TiO 2).
- Титанит (CaTiSiO 5).
- Перовскит (CaTiO 3).
- Титаномагнетит (FeTiO 3 +Fe 3 O 4) и т. д.
Все существующие титаносодержащие руды делят на россыпные и основные. Данный элемент является слабым мигрантом, он может путешествовать только в виде обломов камней или перемещения илистых придонных пород. В биосфере наибольшее количество титана содержится в водорослях. У представителей наземной фауны элемент накапливается в роговых тканях, волосе. Для человеческого организма характерно присутствие титана в селезенке, надпочечниках, плаценте, щитовидной железе.

Физические свойства
Титан - цветной металл, имеющий серебристо-белую окраску, внешне напоминает сталь. При температуре 0 0 С его плотность составляет 4,517 г/см 3 . Вещество имеет низкую удельную массу, что характерно для щелочных металлов (кадмий, натрий, литий, цезий). По плотности титан занимает промежуточную позицию между железом и алюминием, при этом его эксплуатационные характеристики выше, чем у обоих элементов. Основными свойствами металлов, которые учитываются при определении сферы их применения, являются и твердость. Титан прочнее алюминия в 12 раз, железа и меди - в 4 раза, при этом он значительно легче. Пластичность и предел его текучести позволяют производить обработку при низких и высоких температурных значениях, как и в случае с остальными металлами, т. е. методами клепки, ковки, сварки, проката. Отличительная характеристика титана - его низкая тепло- и электропроводность, при этом данные свойства сохраняются при повышенных температурах, вплоть до 500 0 С. В магнитном поле титан является парамагнитным элементом, он не притягивается, как железо, и не выталкивается, как медь. Очень высокие антикоррозийные показатели в агрессивных средах и при механических воздействиях уникальны. Более 10 лет нахождения в морской воде не изменили внешнего вида и состава пластины из титана. Железо в этом случае было бы уничтожено коррозией полностью.
Термодинамические свойства титана
- Плотность (при нормальных условиях) составляет 4,54 г/см 3 .
- Атомный номер - 22.
- Группа металлов - тугоплавкий, легкий.
- Атомная масса титана - 47,0.
- Температура кипения (0 С) - 3260.
- Молярный объем см 3 /моль - 10,6.
- Температура плавления титана (0 С) - 1668.
- Удельная теплота испарения (кДж/моль) - 422,6.
- Электросопротивление (при 20 0 С) Ом*см*10 -6 - 45.
Химические свойства
Повышенная коррозийная устойчивость элемента объясняется образованием на поверхности небольшой оксидной пленки. Она предотвращает (при нормальных условиях) с газами (кислород, водород), находящимися в окружающей атмосфере такого элемента, как металл титан. Свойства его изменяются под воздействием температуры. При ее повышении до 600 0 С происходит реакция взаимодействия с кислородом, в результате образуется оксид титана (TiO 2). В случае поглощения атмосферных газов образуются хрупкие соединения, которые не имеют никакого практического применения, именно поэтому сварка и плавка титана производятся в условиях вакуума. Обратимой реакцией является процесс растворения водорода в металле, он более активно происходит при повышении температуры (от 400 0 С и выше). Титан, особенно его мелкие частицы (тонкая пластина или проволока), сгорает в атмосфере азота. Химическая реакция взаимодействия возможна только при температуре 700 0 С, в результате образуется нитрид TiN. Со многими металлами формирует высокотвердые сплавы, часто является легирующим элементом. В реакцию с галогенами (хром, бром, йод) вступает только при наличии катализатора (высокой температуры) и при условии взаимодействия с сухим веществом. При этом образуются очень твердые тугоплавкие сплавы. С растворами большинства щелочей и кислот титан химически не активен, исключением является концентрированная серная (при длительном кипячении), плавиковая, горячие органические (муравьиная, щавелевая).

Месторождения
Наиболее распространены в природе ильменитовые руды - их запасы оцениваются в 800 млн тонн. Залежи рутиловых месторождений гораздо скромнее, но общий объем - при сохранении роста добычи - должен обеспечить человечество на ближайшие 120 лет таким металлом, как титан. Цена готового продукта будет зависеть от спроса и повышения уровня технологичности производства, но в среднем варьируется в диапазоне от 1200 до 1800 руб./кг. В условиях постоянного технического совершенствования значительно понижается себестоимость всех производственных процессов при их своевременной модернизации. Наибольшими запасами обладают Китай и Россия, также минерально-сырьевую базу имеют Япония, ЮАР, Австралия, Казахстан, Индия, Южная Корея, Украина, Цейлон. Месторождения отличаются объемами добычи и процентным содержанием титана в руде, геологические изыскания продолжаются постоянно, что дает возможность предполагать снижение рыночной стоимости металла и его более широкое применение. Россия на сегодняшний день является наиболее крупным производителем титана.
Получение
Для производства титана чаще всего используется его диоксид, содержащий минимальное количество примесей. Его получают путем обогащения ильменитовых концентратов или рутиловых руд. В электродуговой печи происходит термическая обработка руды, которая сопровождается отделением железа и образованием шлака, содержащего оксид титана. Сернокислый или хлоридный метод применяется для обработки свободной от железа фракции. Оксид титана является порошком серого цвета (см. фото). Металл титан получается при его поэтапной обработке.

Первой фазой является процесс спекания шлака с коксом и воздействия парами хлора. Полученный TiCl 4 восстанавливают магнием или натрием при воздействии температуры 850 0 С. Титановая губка (пористая сплавленная масса), полученная в результате химической реакции, очищается или переплавляется в слитки. В зависимости от дальнейшего направления использования, формируется сплав или металл в чистом виде (примеси удаляются путем нагрева до 1000 0 С). Для производства вещества с долей примесей 0,01 % используется йодидный метод. Он основан на процессе выпаривания из титановой губки, предварительно обработанной галогеном, его паров.
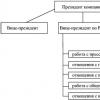
Сферы применения

Температура плавления титана является достаточно высокой, что при легкости металла является неоценимым преимуществом использования его в качестве конструкционного материала. Поэтому наибольшее применение он находит в судостроении, авиационной промышленности, изготовлении ракет, химических производствах. Титан достаточно часто используют в качестве легирующей добавки в различных сплавах, которые обладают повышенными характеристиками твердости и жаропрочности. Высокие антикоррозийные свойства и способность выдерживать большинство агрессивных сред делают этот металл незаменимым для химической промышленности. Из титана (его сплавов) изготавливают трубопроводы, емкости, запорную арматуру, фильтры, используемые при перегонке и транспортировке кислот и других химически активных веществ. Он востребован при создании приборов, работающих в условиях повышенных температурных показателях. Соединения титана используются для изготовления прочного режущего инструмента, красок, пластика и бумаги, хирургических инструментов, имплантатов, ювелирных изделий, отделочных материалов, применяется в пищевой промышленности. Все направления сложно описать. Современная медицина из-за полной биологической безопасности часто использует металл титан. Цена - это единственный фактор, который пока влияет на широту применения данного элемента. Справедливым является утверждение, что титан - материал будущего, изучая который, человечество перейдет на новый этап развития.
Титан (Titanium),Ti,- химический элемент IV группы периодической системы элементов Д. И. Менделеева. Порядковый номер 22, атомный вес 47,90. Состоит из 5 устойчивых изотопов; получены также искусственно радиоактивные изотопы.
В 1791 году английский химик У. Грегор нашёл в песке из местечка Менакан (Англия, Корнуолл) новую «землю», названную им менакановой. В 1795 году немецкий химик М. Клаирот открыл в минерале рутиле неизвестную еще землю, металл которой он назвал Титан [в греч. мифологии титаны - дети Урана (Неба) и Геи (Земли)]. В 1797 году Клапрот доказал тождество этой земли с открытой У. Грегором. Чистый титан выделен в 1910 году американским химиком Хантером посредством восстановления четырёххлористого титана натрием в железной бомбе.
Нахождение в природе
Титан относится к числу наиболее распространённых в природе элементов, его содержание в земной коре составляет 0,6% (весовых). Встречается главным образом в виде двуокиси TiO 2 или её соединений - титанатов. Известно свыше 60 минералов, в состав которых входит титан Он содержится также в почве, в животных и растительных организмах.Ильменит FeTiO 3 ирутил TiO 2 служат основным сырьём для получения титана. В качестве источника титана приобретают значение шлаки от плавкититано-магнетитов и ильменита.
Физические и химические свойства
Титан существует в двух состояниях: аморфный - темносерый порошок, плотность 3,392-3,395г/см 3 , и кристаллический, плотность 4,5 г/см 3 . Для кристаллического титана известны две модификации с точкой перехода при 885° (ниже 885° устойчивая гексагональная форма, выше - кубическая); t° пл около 1680°;t° кип выше 3000°. Титан активно поглощает газы (водород, кислород, азот), которые делают его очень хрупким. Технический металл поддаётся горячей обработке давлением. Совершенно чистый металл может быть прокатан на холоду. На воздухе при обыкновенной температуре титан не изменяется, при накаливании образует смесь окисиTi 2 O 3 и нитридаTiN. В токе кислорода при красном калении окисляется до двуокисиTiO 2 . При высоких температурах реагирует с углеродом, кремнием, фосфором, серой и др. Устойчив к морской воде, азотной кислоте, влажному хлору, органическим кислотам и сильным щелочам. Растворяется в серной, соляной и плавиковой кислотах, лучше всего - в смесиHFиHNO 3 . Добавление к кислотам окислителя предохраняет металл от коррозии при комнатной температуре. Галогениды четырёхвалентного титана, за исключениемTiCl 4 - кристаллические тела, легкоплавкие и летучие в водном растворе гидрализованы, склонны к образованию комплексных соединений, из которых в технологии и аналитической практике имеет значение фтортитанат калияK 2 TiF 6 . Важное значение имеют карбидTiCи нитридTiN- металлоподобные вещества, отличающиеся большой твёрдостью (карбид титан тверже карборунда), тугоплавкостью (TiC,t° пл = 3140°; TiN,t° пл = 3200°) и хорошей электропроводностью.
Химический элемент №22. Титан.
Электронная формула титана имеет вид: 1s 2 |2s 2 2p 6 |3s 2 3p 6 3d 2 |4s 2 .
Порядковый номер титана в периодической системе химических элементов Д.И. Менделеева – 22. Номер элемента обозначает заряд ярда, следовательно у титана заряд ядра - +22, масса ядра – 47,87. Титан находится в четвертом периоде, в побочной подгруппе. Номер периода указывает на количество электронных слоев. Номер группы обозначает количество валентных электронов. Побочная подгруппа указывает на то, что титан относится к d-элементам.
Титан имеет два валентных электрона на s-орбитали внешнего слоя и два валентных электрона наd-орбитали предвнешнего слоя.
Квантовые числа для каждого валентного электрона:
4s4sС галогенами и водородом Ti(IV) образует соединения видаTiX 4 , имеющиеsp 3 →q 4 вид гибридизации.
Титан – металл. Является первым элементом d-группы. Наиболее устойчивым и распространенным являетсяTi +4 . Так же существуют соединения с более низкими степенями окисления –Ti 0 ,Ti -1 ,Ti +2 ,Ti +3 , но эти соединения легко окисляются воздухом, водой или другими реагентами вTi +4 . Отрыв четырех электронов требует больших затрат энергии, поэтому ионTi +4 реально не существует и соединенияTi(IV) обычно включают связи ковалентного характера.Ti(IV) в некоторых отношениях сходен с элементами –Si,Ge,SnиPb, особенно сSn.